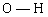 a une longueur de 96 pm et l'angle
a une longueur de 96 pm et l'angle 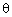 qu'elles forment entre elles vaut 105,5°. Dans l'échelle de Pauling, l'oxygène a une électronegativité de 3,5 et l'hydrogène une électronégativité de 2,2.
qu'elles forment entre elles vaut 105,5°. Dans l'échelle de Pauling, l'oxygène a une électronegativité de 3,5 et l'hydrogène une électronégativité de 2,2. 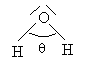
T.S.1 C.I.R.A Donné en décembre 1997 ATOMISTIQUE
EXERCICE :
La figure ci-après rappelle la géométrie de la molécule d'eau. Chacune des liaisons 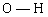 a une longueur de 96 pm et l'angle
a une longueur de 96 pm et l'angle 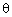 qu'elles forment entre elles vaut 105,5°. Dans l'échelle de Pauling, l'oxygène a une électronegativité de 3,5 et l'hydrogène une électronégativité de 2,2.
qu'elles forment entre elles vaut 105,5°. Dans l'échelle de Pauling, l'oxygène a une électronegativité de 3,5 et l'hydrogène une électronégativité de 2,2.

1) Calculer le moment dipolaire de la molécule d'eau sachant que chaque liaison 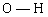 a un moment dipolaire de 1,53 D (1 debye =
a un moment dipolaire de 1,53 D (1 debye = 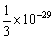 Cm).
Cm).
Représenter le vecteur moment dipolaire 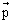 de la molécule d'eau.
de la molécule d'eau.
2) L'eau est un solvant des composés ioniques. La mise en solution d'un soluté ionique correspond à la destruction du réseau cristallin, à la libération des ions et à leur hydratation (ou solvatation : les ions hydratés sont entourés de molécules d'eau).
On s'intéresse à la dissolution de 1 mol de bromure de sodium NaBr.
a) A l'aide d'un diagramme énergétique, représenter les étapes de :
- la dislocation et dispersion des ions. (Processus endothermique).
- l'hydratation des ions (processus exothermique).
en prenant pour référence des énergies le cristal solide et l'eau.
b) Calculer l'énergie de dissolution de 1 mol de NaBr en utilisant les tableaux 1 et 2.Données :
Tableau 1 : énergie de cohésion de quelques cristaux ioniques
| Cristal | ER (kJ/mol) | Cristal | ER (kJ/mol) |
| NaF | 923 |
MgO | 3791 |
| NaCl | 782 |
CaO | 3401 |
| NaBr | 747 |
SrO | 3223 |
| NaI | 704 |
BaO | 3054 |
Tableau 2 : énergies en kJ/mol d'hydratation
ions |
F- |
Cl- |
Br- |
I- |
Li+ |
-1041 |
-898 |
-867 |
-854 |
Na+ |
-927 |
-784 |
-753 |
-740 |
K+ |
-844 |
-701 |
-670 |
-657 |
Ag+ |
-993 |
-850 |
-819 |
-806 |