T.S.1 C.I.R.A
Donné en 1999
ATOMISTIQUE
EXERCICE :
Données numériques :
Constante de Planck : h = 6,62.10 -34 J.s
Célérité de la lumière dans le vide : c =3.10 8 m.s-1
Charge élémentaire : 1,6.10-19 C
1) Le numéro atomique du sodium Na est Z = 11.
Donner la configuration électronique de l' atome de sodium dans son état fondamental.
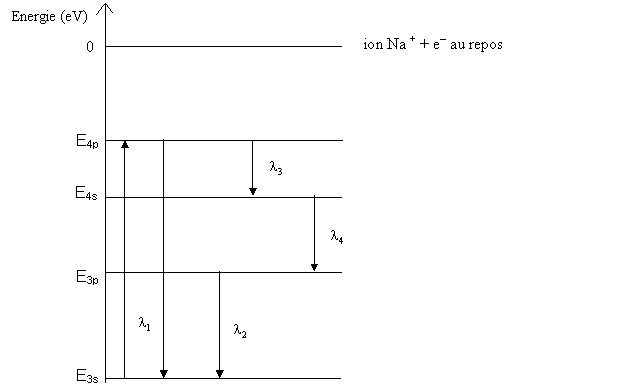
2) Le schéma ci-dessous représente le diagramme simplifié de quelques niveaux d'énergie de l'atome de sodium, un électron se trouvant sur le niveau 3s à l'état fondamental.
Le sodium (sous forme de vapeur) absorbe la radiation 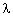 1 = 330,3 nm. Lorsque les atomes se désexcitent, ils émettent les radiations de longueurs d'onde :
1 = 330,3 nm. Lorsque les atomes se désexcitent, ils émettent les radiations de longueurs d'onde :
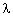 1 = 330,3 nm
1 = 330,3 nm
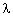 2 = 589 nm
2 = 589 nm
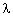 3 = 2208,4 nm
3 = 2208,4 nm
et 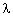 4
4
a) A quels domaines des ondes lumineuses appartiennent les radiations de longueur d'onde 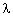 1,
1, 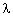 2 et
2 et 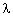 3 ?
3 ?
b) Expliquer le phénomène de l'absorption de 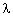 1 et celui de l'émission de
1 et celui de l'émission de 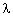 3.
3.
c) Sachant que l'énergie d'ionisation de l'atome de sodium dans son état fondamental est de 5,14 eV, en déduire l'énergie du niveau 3s et calculer les énergies des niveaus 3p, 4s, et 4p.
d) Calculer la longueur d'onde 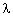 4.
4.
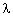 1 = 330,3 nm. Lorsque les atomes se désexcitent, ils émettent les radiations de longueurs d'onde :
1 = 330,3 nm. Lorsque les atomes se désexcitent, ils émettent les radiations de longueurs d'onde :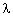 1 = 330,3 nm
1 = 330,3 nm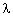 2 = 589 nm
2 = 589 nm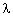 3 = 2208,4 nm
3 = 2208,4 nm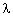 4
4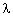 1,
1, 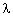 2 et
2 et 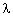 3 ?
3 ?
