 du chlorure de lithium.
du chlorure de lithium. T.S.1 C.I.R.A Donné en 2001 ATOMISTIQUE
EXERCICE :
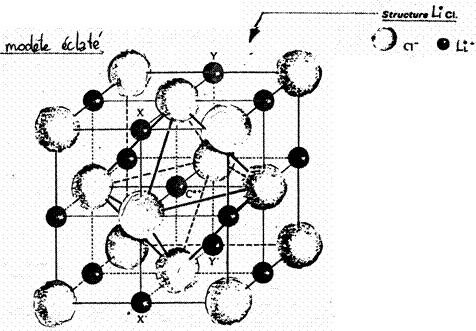
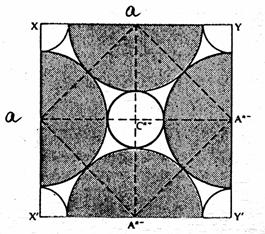
Le chlorure de lithium est un composé ionique cristallisant dans la structure cubique à faces centrées de type chlorure de sodium. Le coté du cube est noté a (il est appelé paramètre).
La figure 3 donne une représentation de la maille élémentaire de ce cristal (modèle éclaté + modèle compact).
1) Déterminer le nombre d'ions Cl- et Li+ présent dans une maille élémentaire. En déduire le nombre d'entités LiCl présentes dans cette maille.
2) Calculer le paramètre a et le volume de la maille.
3) Calculer la masse volumique 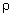 du chlorure de lithium.
du chlorure de lithium.
Données :
Le rayon de l'ion chlorure Cl- est : r (Cl-) = 181 pm
Le rayon de l'ion lithium Li+ est : r (Li+) = 79,1 pm
Nombre d'Avogadro : NA = 6,023.10 23 mol-1.
Masse molaire du chlorure de lithium MLiCl = 42,4 g/mol