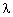 est mesurée égale à 589,3 nm.
est mesurée égale à 589,3 nm. T.S.1 C.I.R.A Donné en octobre 2003 ATOMISTIQUE
EXERCICE :
Données numériques :
Constante de Planck : h = 6,63.10 -34 J.s
C
élérité de la lumière dans le vide : c =3.10 8 m.s-1
1 eV = 1,6.10-19 J
1) Le numéro atomique du sodium Na est Z = 11.
Donner la configuration électronique de l' atome de sodium dans son état fondamental et représenter son schéma de Lewis. Donner également la configuration électronique de l'ion sodium Na+.
2) Le spectre d'émission de l' atome de sodium possède une raie intense dont la longueur d' onde 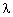 est mesurée égale à 589,3 nm.
est mesurée égale à 589,3 nm.
Donner la relation entre l' énergie d' un photon et la longueur d' onde de la radiation correspondante.
Calculer l' énergie d' un photon de longueur d' onde 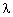 = 589,3 nm. (Le résultat sera exprimé en joule puis en électron-volt).
= 589,3 nm. (Le résultat sera exprimé en joule puis en électron-volt).
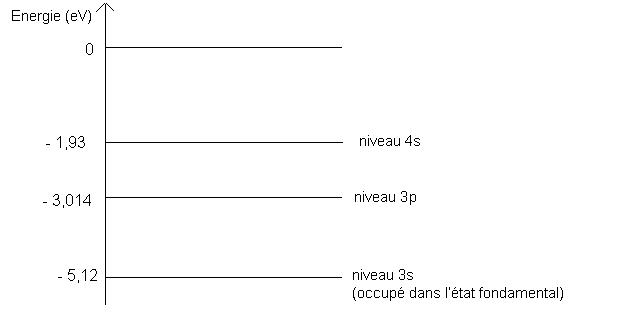
A l'aide du diagramme simplifié des niveaux d'énergie de l'électron externe de l' atome de sodium, indiquer à quelle transition de l'électron externe correspond la raie d'émission 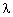 = 589,3 nm.
= 589,3 nm.
3) a) Déterminer l'énergie d'ionisation de l'atome de sodium à partir de son fondamental.
b) La longueur d' onde maximale d' un photon pouvant produire cette ionisation étant 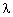 M = 242 nm, dans quel domaine (Ultra-violet, visible, Infra-rouge) se situe la lumière capable d'ioniser l'atome de sodium à partir de son état fondamental ? Justifier votre réponse, en précisant les limites du spectre de la lumière visible.
M = 242 nm, dans quel domaine (Ultra-violet, visible, Infra-rouge) se situe la lumière capable d'ioniser l'atome de sodium à partir de son état fondamental ? Justifier votre réponse, en précisant les limites du spectre de la lumière visible.