Donné en mars 2002.
T.S.2 C.I.R.A E.D.F. DEVOIR 9 DE PHYSIQUE
Cette épreuve est composée d'un problème comportant deux parties. (Note : la partie 2 a subi des modifications par rapport à l' énoncé original ).
Le document n°2 est à rendre avec la copie.
- La synthèse du gaz ammoniac est réalisée dans un réacteur chimique. L’ équation-bilan de la réaction est la suivante
N2 + 3H2 ![]() 2
N H3
2
N H3
gaz gaz gaz
- Pour obtenir un bon rendement, on réalise cette synthèse sous pressions relativement élevées.
N.B. A chaque utilisation du diagramme de Mollier, il est demandé de justifier les réponses et les valeurs trouvées.
PREMIERE PARTIE :
Dans cette partie, on négligera la vitesse de l'ammoniac dans le dispositif expérimental schématisé sur le document n°1, et on considère une masse d’ammoniac de un kilogramme.
1.1. L'ammoniac est produit avec un débit de 1500 kg.h-1. Il sort du réacteur à une température t1 = 150°C et sous une pression p1 = 75 bars. Il traverse alors une vanne, en effectuant une détente isenthalpique, qui amène sa pression à une valeur p2= 25 bars.
1.1. a. Sur le diagramme de Mollier ci-joint [document n°2 (80 ko à télécharger)], placer le point A représentant l’état du gaz à la sortie du réacteur.
1.1. b. A l’aide de ce même diagramme placer le point B représentant l'état du gaz à la sortie de la vanne.
1.1. c. En déduire la température t2 du gaz à cette sortie.
1.2. L’ammoniac travers ensuite un réfrigérant dans lequel il est refroidi sous pression constante p2 jusqu'à atteindre un taux de vapeur x = 0,25. Il est alors stocké dans un réservoir placé dans une grande enceinte pressurisée à une pression pext = 6 bars, pour des raisons de sécurité, les rejets de l'ammoniac dans l'atmosphère étant interdits.
1.2.a. Placer le point C, représentant l'état du gaz à la sortie du réfrigérant sur le diagramme de Mollier. En déduire la température t 3 de l’ammoniac dans le réservoir de stockage.
1.2.b. Toujours à l’aide du diagramme, calculer la quantité de chaleur cédée par l'ammoniac au réfrigérant, en kilojoules par kilogramme.
On rappelle l’équivalence d’énergie et l'unité usuelle : 1 kcal = 4,18 kJ.
DEUXIEME PARTIE :
On a fixé sur le réservoir une soupape de sécurité qui doit permettre d'évacuer la totalité du débit d’ammoniac produit dans le réacteur, en cas d’incident.
On peut assimiler cette soupape de sécurité à une tuyère convergente et considérer la détente dans la soupape comme isentropique.
A la suite d’un incident, l’ammoniac liquide s’est entièrement vaporisé dans le réservoir, sous la pression de 25 bars, et l’on est en présence de vapeur d'ammoniac à la température de 100 °C (point D).2. 1 Quelle est la pression p4 de l’ammoniac au col de la tuyère, après la détente (point E) ?
On rappelle l'expression de la pression critique pcol d'une vapeur au col d'une tuyère convergente :
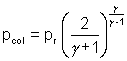
avec
pr : pression dans le réservoir, 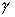 :
rapport des capacités calorifiques massives respectivement à pression constante
et à volume constant. On prendra
:
rapport des capacités calorifiques massives respectivement à pression constante
et à volume constant. On prendra 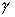 = 1,30.
= 1,30.
En déduire la température t 4 au col de la tuyère (point E).
Retrouve t’ on une valeur concordante pour la température du gaz au col en appliquant la loi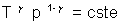 entre
les points D et E ?
entre
les points D et E ?
2.2. Calculer, à l’aide du diagramme de Mollier, la masse volumique de l’ammoniac au niveau du col.
Note : Les courbes iso-volumes sur le diagramme de mollier sont données avec le volume massique v en L / kg.
2.3 Calculer la vitesse de l’ammoniac au niveau du col. (on négligera la vitesse de l’ammoniac gazeux dans le réservoir). On utilisera le premier principe généralisé de la thermodynamique et le diagramme.
En
assimilant NH3 à un gaz parfait, comparer avec la vitesse théorique :
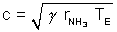 en prenant r NH3 = 489 J.kg –1.K –1.
en prenant r NH3 = 489 J.kg –1.K –1.
2.4. En déduire la section S du col de la tuyère.