Exercice
1 Exercice 2
Premier exercice
Énergie nucléaire
Dans le soleil et les étoiles, la température et la pression sont assez élevées
pour permettre l’existence de réactions de fusion. Le combustible fondamental
est constitué de protons, ou noyaux d’hydrogène  .
.
Le bilan des réactions nucléaires
dans le soleil peut s’écrire:

où 4 noyaux d’hydrogène ont fusionné après un cycle complexe, qui n’est pas
étudié ici. Le produit principal est l’hélium, il est accompagné de 2 particules
notées  et de
deux neutrinos
et de
deux neutrinos 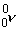 dont le rôle ne sera pas non plus étudié.
dont le rôle ne sera pas non plus étudié.
1. Quels sont le nom et les
caractéristiques des particules notées 
2. En précisant les lois appliquées,
déterminer la grandeur notée x.
3. Déterminer, en MeV, l’énergie
disponible par noyau d’hélium formé.
4. En déduire l’énergie disponible,
en kJ par mole d’hélium formé.
Données :
• unité de masse atomique 1u = 931,5 MeV/c 2
=1,6605.10 -27 kg
• célérité de la lumière: c = 2,998.10
8 m.s -1
• masse des particules
e+: m e = 5,486. 10 -4 u;
n : m n
=0;
• masse des noyaux correspondant aux nucléides: m  = 1,007276 u;
= 1,007276 u;
m  = 4,001502u
= 4,001502u
• 1 eV= 1,6.10 -19J
• nombre d’Avogadro:
NA = 6,02. 10 23 mol -1
Deuxième
exercice
Mesure de la Demande Chimique on Oxygène (DCO) d’une
eau usée
Les matières organiques rejetées
dans les effluents liquides par les particuliers et les entreprises sont responsables
de la baisse du taux de dioxygène contenu dans l’eau, car elles consomment
du dioxygène pour leur oxydation.
Pour estimer la teneur en ces
matières, on procède à une oxydation par voie chimique. La D.C.O. est le résultat
exprimé en mg de dioxygène nécessaire à l’oxydation d’un litre d’ effluent.
La demi équation d’oxydoréduction
correspondant à la réduction du dioxygène est:

Une oxydation par le dioxygène
conduirait à des résultats difficiles à reproduire. Aussi, utilise-t-on un
oxydant fort (le dichromate de potassium, par exemple) à la place. Il faut
ensuite convertir les résultats.
On porte à ébullition pendant
une heure un mélange contenant 10,00 cm3 de l’eau à analyser et
5,00 cm3 de solution de dichromate de potassium (2K +,
Cr2O72-) de concentration 0,060 mol.L –1.
On y a ajouté l’acide nécessaire à la réaction, ainsi qu’un catalyseur, sans
modifier le volume de 15,00 cm3.
On mesure alors par une méthode
spectrophotométrique la concentration de dichromate restant. On trouve 0,016
mol.L –1.
1. Ecrire la demi équation
d’oxydoréduction mettant en jeu le couple Cr2O72-
I Cr 3+.
2. Déterminer la concentration
initiale du dichromate dans le mélange à ébullition.
3. Déterminer la quantité de
matière de dichromate ayant réagi.
4. En comparant les demi équations
relatives aux couples mettant en jeu les deux oxydants concernés Cr2O72-
I Cr 3+ et O2 / H2O, justifier que
si il faut 1 mole de Cr2O72- pour oxyder
une quantité de matière réductrice de l’eau étudiée il faudrait 3/2 moles
de dioxygène.
5. En déduire le nombre de
moles de dioxygène qu’il aurait fallu utiliser. Calculer la DCO de l’eau étudiée.
Donnée: masse
molaire de l’oxygène : M(0) = 16 g. mol–1.
![]() .
.![]()
![]() et de
deux neutrinos
et de
deux neutrinos ![]() dont le rôle ne sera pas non plus étudié.
dont le rôle ne sera pas non plus étudié.![]()
![]() = 1,007276 u;
= 1,007276 u;![]() = 4,001502u
= 4,001502u